基于間充質干細胞的溶瘤免疫療法增強了CAR-T細胞的抗腫瘤功能和效果
?IsoPlexis單細胞蛋白組學檢測技術證明了,利用表達IL-12和PD-L1阻斷蛋白的組合基因工程腺病毒感染間充質干細胞(CAd12_PD-L1 MSCs)促進了HER.2-CAR-T細胞的腫瘤抗原特異性多功能性,并且該多功能性與CAR-T細胞在體外和體內抗腫瘤活性增強相關。
?單細胞多重蛋白組學技術也揭示了HER.2 CAR-T細胞的多功能性增加對腫瘤抗原的反應增強,CAd12_PD-L1骨髓間充質干細胞治療組中有34%的CD4+和40%的CD8+CAR-T多功能性細胞,而HER.2 CAR-T單一治療組中僅有5%的CD4+和16%的CD8+CAR-T多功能性細胞。
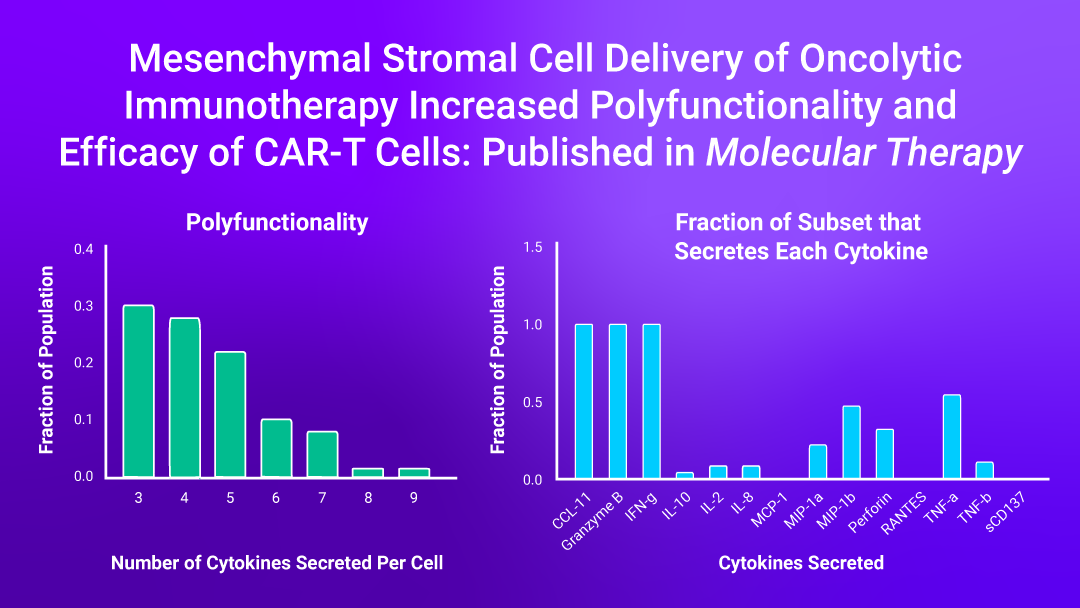
?當腫瘤細胞和CAd12_PD-L1間充質干細胞MSC載體共培養時,多功能CD4+HER.2 CAR-T細胞顯示出共同分泌IFN-g、顆粒酶B和CCL11的大多數細胞因子的特征,而多功能CD8-HER.2 CAR-T細胞與IFN-g、顆粒酶B、TNF-a和穿孔素共同分泌具有更大的細胞溶解活性,這解釋了CAd12_PD-L1 MSCs提高體內HER.2 CAR-T細胞抗腫瘤活性相關機制。
?IsoPlexis單細胞功能蛋白質組學技術為CAd12_PD-L1 MSC在增強HER.2 CAR-T細胞多功能性和效應細胞因子方面提供了獨特的機制見解,并證明了溶瘤免疫療法與CAR-T細胞療法的聯合治療在促進抗腫瘤功能方面的方法學和效果。
腫瘤微環境 (TME) 的復雜性可以限制CAR-T細胞的浸潤,并為使用過繼細胞療法治療實體瘤設置障礙。TME會產生免疫抑制蛋白、細胞因子和趨化因子,從而抑制細胞毒性T細胞反應。因此,確認可破壞TME同時促進T細胞持久性功能驅動因素的療法是實體瘤治療的一個重要目標。基于工程化腺病毒 (OAd) 的溶瘤免疫療法可破壞TME并刺激相關CAR-T細胞,增強宿主抗腫瘤免疫反應。但是溶瘤病毒如何遞送到相應病灶內的腫瘤部位極具挑戰性,而且由于患者對病毒治療的天然或適應性免疫反應,在某些情況下無法進行靜脈給藥。為了克服這些挑戰,利用特定細胞載體系統如間充質干細胞 (MSC) 可將OAd遞送至腫瘤部位。最近發表在Molecular Therapy上的一項研究通過IsoPlexis的單細胞蛋白質組學技術證實了OAd細胞遞送聯合CAR-T療法在治療實體瘤方面的方法學及效果。
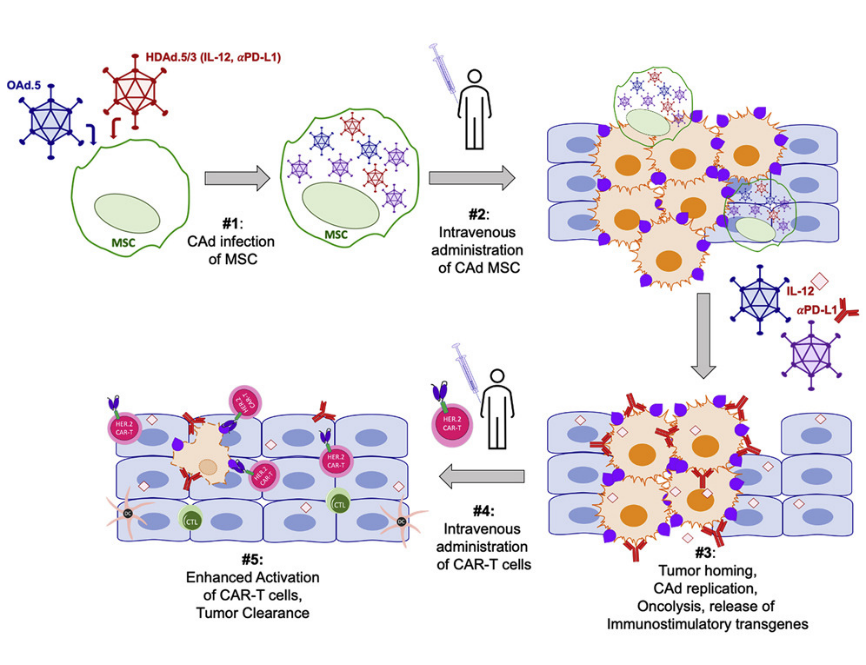
利用功能性單細胞蛋白質組學技術解決溶瘤免疫療法破壞腫瘤微環境的挑戰
McKenna等科學家在研究中使用間充質干細胞(MSCs)系統的遞送包含OAd和輔助性腺病毒(HDAd) 并表達白介素-12(IL-12)和PD-L1(程序性死亡配體1)阻斷蛋白的組合載體[CAd]。CAd感染的MSCs可以遞送并釋放有功能的病毒感染和裂解肺腫瘤細胞,同時通過釋放IL-12和PD-L1阻斷蛋白增強CAR-T細胞抗腫瘤活性。這種方法與靶向HER2特異性CAR-T細胞療法的結合可在體外消除了3D培養的腫瘤球體,并且在體內則觀察到抑制了兩種原位肺癌模型的腫瘤生長。與單一CAR-T細胞治療相比,組合載體CAd通過間充質干細胞MSCs遞送療法增加了人T細胞的總體數量,并增強了其多功能細胞因子的分泌。
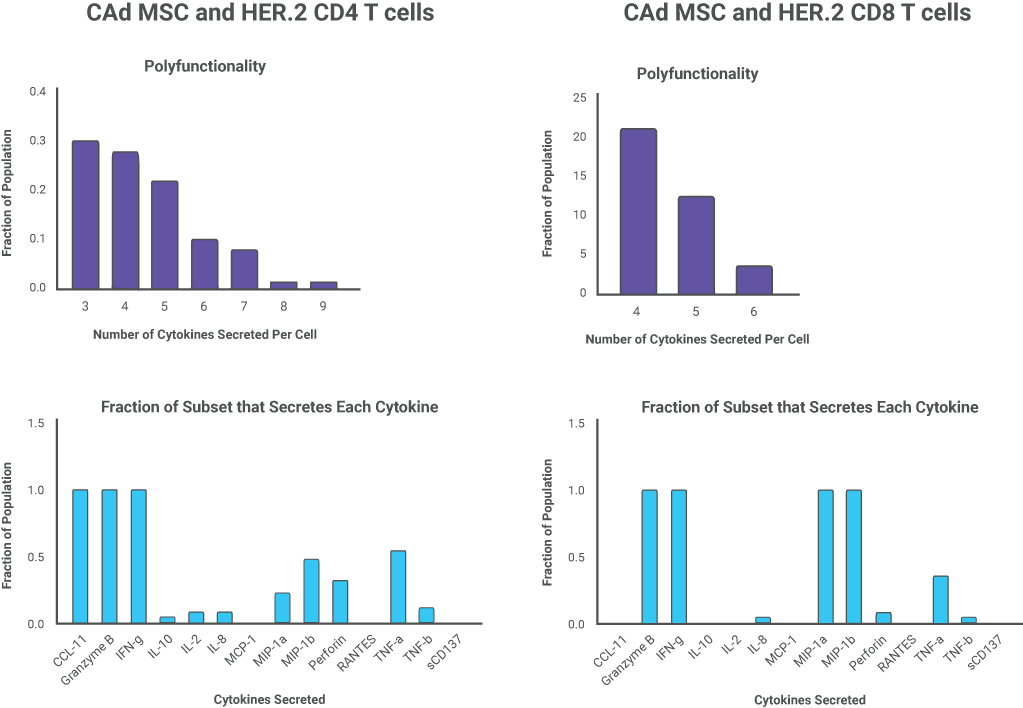
單細胞分泌蛋白質組學鑒定與CAd感染的骨髓間充質干細胞治療的CAR-T細胞抗腫瘤功能改善相關的上調T細胞多功能性
研究中也提到IsoPlexis的功能蛋白質組學技術來分析CAd感染的MSC提高HER.2 CAR-T細胞功效的機制。單細胞分泌組芯片用于測量單個CAR-T細胞的多功能性。在以前的研究中,多功能性與抗腫瘤活性有關,并可以很好預測臨床結果。IsoPlexis單細胞分泌蛋白質組學技術發現CAd-MSC與腫瘤細胞系共培養的HER2 CAR-T細胞相比未經CAd-MSC共同培養的CAR-T細胞具有更多的多功能性T細胞(分別占CD4+和CD8+細胞的34%和40% VS 5%和16%)。
聯合治療通過增加CAR-T細胞中多功能細胞的數量有效地增強了HER.2 CAR-T細胞的抗腫瘤活性。
在IsoSpeak軟件對相關細胞亞群進行進一步分析中發現,與未感染Ad的MSCs共培養的一部分CD4+細胞主要分泌IL-8,而與CAd MSCs共培養的一個CD4+細胞亞群中細胞分泌多達9種細胞因子,其中大部分同時分泌IFN-g、Granzyme B和CCL11。CAd MSCs促進了CD4+ CAR-T細胞對腫瘤細胞的促炎細胞因子的產生。在CD8+ CAR-T細胞亞群中則發現CD8+ HER.2 CAR-T細胞分泌相關效應因子的增多,包含INF-g,Granzyme B,MIP-a等。經CAd MSCs處理的CD4+和CD8+ CAR-T細胞均顯示CCL11的分泌增多,(CCL11是一種與粘附分子和T細胞趨化性增加相關的趨化因子)。IsoPlexis功能性單細胞蛋白質組學技術揭示了CAd MSCs增強CAR-T細胞功效的抗腫瘤活性相關機制。
這種抗腫瘤活性在隨后的小鼠肺癌模型中的實驗結果一致,利用IsoPlexis技術可以在更短的時間內利用體外3D細胞培養模型提供與體內生物學反應相一致的結果和見解。CAd-MSCs治療聯合HER.2 CAR-T治療與單獨CAR-T治療相比,能夠顯著抑制腫瘤生長。肺部腫瘤內T細胞數據顯示,與單一CAR-T治療組相比,CAd-MSC聯合CAR-T治療細胞組中CD8+T細胞的耗竭標志物Tim3的表達降低,表明CAd-MSC促進了T細胞的持久性。使用異種移植肺腫瘤模型進行的小鼠體內研究得出的結果與3D培養細胞中結果相一致:聯合治療實現腫瘤在2周內完全清除,且未觀察到任何負面作用。
總結McKenna等人的研究結果揭示了CAd-MSCs和CAR-T獨特的聯合療法的抗腫瘤活性內在機制。聯合治療可破壞TME,改善T細胞浸潤,增強T細胞的多功能性,而多功能性與抗腫瘤活性相關。IsoPlexis通過IsoCode單細胞分泌蛋白組芯片解決方案獨特地揭示了這一點,該解決方案能夠全自動檢測數千個單細胞中32+種細胞因子數據,相對傳統技術僅捕獲少數功能蛋白,可以在更短的時間內捕獲全系列功能蛋白。IsoPlexis單細胞和多組學平臺為科學家節省了寶貴的時間和金錢,加速了臨床研究進展。
參考文獻:
1. McKenna et al., Mesenchymal stromal cell delivery of oncolytic immunotherapy improves CAR-T cell antitumor activity, Molecular Therapy (2021)